
題目列表(包括答案和解析)
| 實驗編號 | 硫酸的質量分數(shù)/% | 反應的溫度 | Fe絲消失的時間/S |
| ① | 3 | 20 | 500 |
| ② | 6 | 20 | 300 |
| ③ | 6 | 30 | 80 |
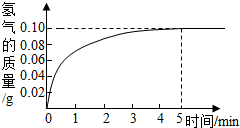 某化學興趣小組在做Fe和CuSO4溶液反應實驗時,發(fā)現(xiàn)生成Cu的同時有氣泡產(chǎn)生.為了進一步研究做了如下實驗:
某化學興趣小組在做Fe和CuSO4溶液反應實驗時,發(fā)現(xiàn)生成Cu的同時有氣泡產(chǎn)生.為了進一步研究做了如下實驗: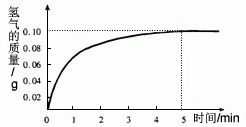
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com