【題目】已知A���、B、C�����、D和E都是元素周期表中前36號的元素��,它們的原子序數(shù)依次增大。A與其他4種元素既不在同一周期又不在同一主族��。B和C屬同一主族��,D和E屬同一周期��,又知E是周期表中1~18列中的第7列元素�。D的原子序數(shù)比E小5�,D跟B可形成離子化合物,其晶胞結(jié)構(gòu)如圖���。
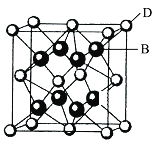
請回答:
(1)A元素的名稱是______����。
(2)B的元素符號是__________��,C的元素符號是______����。
(3)E屬元素周期表中第________周期第______族的元素,其元素名稱是______���,它的+2價(jià)離子的電子排布式為________���。
(4)從圖中可以看出����,D跟B形成的離子化合物的化學(xué)式為______���;該離子化合物晶體的密度為a g·cm-3�,則晶胞的體積是______(只要求列出算式)����。